[충청뉴스 이성현 기자] 국내 연구진이 알츠하이머병의 두 핵심 병리 단백질인 타우와 아밀로이드 베타가 실제로 직접 소통하며 독성을 조절한다는 사실을 세계 최초로 분자 수준에서 규명했다.
한국과학기술원(KAIST)은 화학과 임미희 교수 연구팀이 한국기초과학지원연구원(KBSI) 첨단바이오의약연구부 이영호 박사 연구팀을 비롯해 한국과학기술연구원(KIST) 등과 알츠하이머병의 주요 병리 단백질 중 하나인 타우의 미세소관 결합 영역이 아밀로이드 베타와 직접적인 상호작용을 통해 응집 경로를 변화시키고 세포 독성을 완화할 수 있음을 분자 수준에서 규명했다고 24일 밝혔다.
알츠하이머병은 병리학적으로 신경세포 안에서 영양분과 신호물질을 운반하는 수송로 역할을 하는 단백질인 ‘타우’의 응집으로 형성된 ‘신경섬유 다발’과, 뇌 속 신경세포 막에 뇌 발달, 세포 간 신호 전달, 신경세포 회복 등에 관여하는 아밀로이드 전구 단백질이 어떤 효소에 의해 비정상적으로 잘린 아밀로이드 베타 조각이 뭉쳐있는 ‘아밀로이드 베타 응집체’로 ‘아밀로이드 플라크(노인성 반점)’ 형태로 세포 내부와 외부에 각각 축적되는 특징을 보인다.
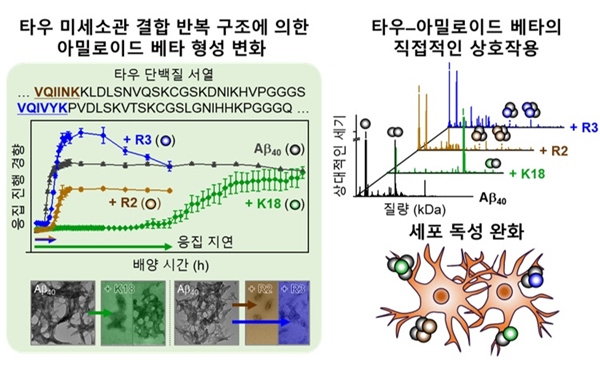
연구팀은 타우 단백질이 신경세포 안에서 미세소관(세포 내 수송로)에 붙는 구조 중 'K18, R2, R3'이 아밀로이드 베타와 결합해 ‘타우–아밀로이드 베타 복합체(이종 복합체)’를 만들게 됨을 확인했다.
특히 이들 타우 단백질의 반복 구조는 질환 발병과 연결되는 아밀로이드 응집이 처음 뭉치기 시작하는 과정(핵 형성 단계)을 지연시키고 질환 진행에 관계되는 아밀로이드 베타의 응집 속도와 구조적 형태를 동시에 변화시켰다. 그 결과 뇌 세포 내·외 환경 모두에서 아밀로이드 베타가 일으키는 독성 수준을 뚜렷하게 감소시킨 것ㅇ디ㅏ.
아울러 타우 단백질의 특정부분(미세소관 결합 반복 구조)은 물과 잘 섞이는 성질(친수성)과 물과 잘 안 섞이는 성질(소수성)을 동시에 가지고 있고 이 두 성질의 균형이 잘 맞을 때, 타우는 아밀로이드 베타를 더 잘 결합하게 된다. 즉 타우의 성질이 아밀로이드 베타와의 결합력·응집 경로·독성 조절 능력을 결정짓는 핵심 요인임을 입증했다.
이영호 박사는 “이번 연구는 난치성 신경퇴행성 질환인 치매의 발병 및 진행에 관한 새로운 분자 메커니즘을 규명했으며 특히, 분자 간 상호작용과 단백질 응집을 중심으로 한 다학제적 융합연구는 알츠하이머병과 파킨슨병 사이의 질환 간 상호작용은 물론, 치매, 당뇨병, 암 등 여러 질환 사이의 상호 연관성을 밝히는 데 중추적 역할을 할 것으로 기대된다”고 설명했다.


